Introducción: La hiperplasia mamaria virginal es el crecimiento mamario desproporcionado en niñas con niveles hormonales normales, sin función lactante que puede generar disconformidad. Caso clínico: Adolescente femenina, edad: 11,6 años, con hipercrecimiento mamario bilateral de progresión rápida, dolorosa. Mamas voluminosas. Pezones aplanados. Estudio hormonal normal. Ultrasonido mamario: abundante tejido fibroglandular, congestión y vasculatura prominente. Resonancia magnética: T1 mamas predominantemente hipointensas relaciónadas con escaso tejido graso. T2: hiperintensidad del tejido que sugiere congestión. Cirugía: Mamoplastia reductora con injerto areola-pezón bilateral. Peso del tejido resecado: 22,6 kg. Histología: hiperplasia mamaria virginal, hiperplasia ductal sin atipias y focos pseudoangiomatosos. Reevaluación postoperatoria (6 semanas): recrecimiento mamario bilateral. Inició tamoxifeno, dosis: 20 mg/día por 6 meses y reducción a 10 mg/día para completar tratamiento 12 meses, regresión resultante del volumen mamario. Refiere satisfacción. Cuatro meses posterior a la suspensión del tamoxifeno, volumen mamario estable. Discusión: La hiperplasia mamaria virginal, infrecuente, suele corregirse tempranamente, por presentación agresiva. Ultrasonido y resonancia magnética permitieron aproximación diagnóstica a esta patología y la exclusión de otras ocultas. La combinación cirugía/tamoxifeno es eficaz para evitar el recrecimiento del tejido remanente. El tamoxifeno fue bien tolerado, sin efectos adversos. La hiperplasia estromal pseudoangiomatosa es una lesión proliferativa benigna mamaria infrecuente. En este caso, sin presentar masa palpable, incidental. Diagnóstico diferencial: angiosarcoma de bajo grado. Conclusión: La hiperplasia mamaria virginal amerita tratamiento sintomático, por su repercusión biopsicosocial. Síntomas severos requieren cirugía. La mamoplastia reductora debe considerarse primera línea, por generar mejor resultado y estimar el tratamiento médico post-quirúrgico ante la posibilidad de recurrencia. RCM 2023. 62; 156(2): 62-75.
Palabras clave: Hipertrofia virginal mamaria, Gigantomastia. mamoplastia de reducción, hiperplasia seudoangiomatosa
Introduction: The Virginal mammary hyperplasia is the disproportionate breast growth in girls with normal hormonal levels, without lactating function that can cause discomfort. Clinical case: A female adolescent, age: 11.6 years, with painful, rapidly progressive bilateral breast hypergrowth. Bulky breasts. Flattened nipples. Normal hormonal study. Breast ultrasound: abundant fibroglandular tissue, engorgement and prominent vasculature. Magnetic resonance: T1 predominantly hypointense breasts related to little fatty tissue. T2: Tissue hyperintensity suggestive of congestion. Surgery: Reductive mammoplasty with bilateral nipple-areola graft. Weight of resected tissue: 22.6 kg. Histology: virginal mammary hyperplasia, ductal hyperplasia without atypia and pseudoangiomatous foci. Postoperative reassessment (6 weeks): bilateral breast regrowth. Tamoxifen was started, dose: 20 mg/day for 6 months and reduction to 10 mg/day to complete 12 months treatment, resulting regression of breast volume. Refers satisfaction. Four months after stopping Tamoxifen, stable breast volume. Discussion: The infrequent virginal mammary hyperplasia is usually early corrected, due to aggressive presentation. Ultrasound and magnetic resonance allowed a diagnostic approach to this pathology and the exclusion of other hidden ones. The surgery/Tamoxifen combination is effective in preventing the regrowth of remaining tissue. The Tamoxifen was well tolerated, with no adverse effects. Pseudoangiomatous stromal hyperplasia is a rare benign proliferative lesion of the breast. In this case, without presenting a palpable incidental mass. Differential diagnosis: low-grade Angiosarcoma. Conclusion: Virginal Mammary Hyperplasia requires symptomatic treatment, due to its biopsychosocial repercussions. Severe symptoms require surgery. The Reduction mammoplasty should be considered first line, as it generates better results and estimates post-surgical medical treatment given the possibility of recurrence. RCM 2023. 62; 156(2): 62-75.
Key words: Virginal Mammary Hypertrophy. Gigantomastia. Reduction Mammoplasty. PseudoAngiomatous Hyperplasia
El crecimiento mamario desproporcionado en niñas con niveles hormonales normales, en ausencia de menstruación y sin finalidad funcional lactante, es conocido como hiperplasia mamaria virginal y al parecer, se debe a una respuesta desproporcionada del tejido mamario al estrógeno. Todas las dolencias físicas, dermatológicas y psíquicas que acompañan a este cuadro, a menudo simétrico, suele llevar a una situación límite a los pacientes a una edad muy temprana (1).
La gigantomastia es una condición patológica infrecuente que se caracteriza por un desarrollo mamario excesivo. Sin definición universalmente aceptada, muchos autores la definen como tejido mamario excesivo que contribuye a más del 3 % del peso corporal (2), o que requiere reducción de más de 1500 g de cada mama (3,4). Tales definiciones son limitadas porque el diagnóstico de gigantomastia se puede confirmar solo después de la cirugía, a pesar de estimar la magnitud de la resección antes de la operación (5). Netscher et al consideran que esta patología se define mejor por los síntomas que por la cantidad de tejido extirpado (6).
La primera descripción de esta enfermedad fue 1.669 por Durston, sin embargo formalmente documentada y publicada por Henry Albert en 1.910 denominándola ¨Gigantomastia Juvenil o Hipertrofia Virginal Mamaria¨(7). Es una condición poco frecuente. Neinstein en una revisión realizada en 40 años de pacientes adolescentes con patología mamaria, determinó que la hipertrofia virginal representaba el 2% (8). En el 2011 Hope et al, reportó en su metaanálisis de reporte de casos entre 1910 y 2009, un total de 65 pacientes (9). Hisham et al, describió adicionalmente 9 casos publicados entre los años 2010-2017 (10).
Se trata de un trastorno raro y benigno, de etiología incierta, en la que se produce un rápido y continuo crecimiento del tejido mamario durante la pubertad; a menudo hay un período de seis meses de crecimiento extremo y luego un período más lento pero sostenido. Ocurre más comúnmente en niñas entre ocho y 16 años de edad; se desarrolla de forma esporádica, aunque se han reportado casos familiares (11,12). El crecimiento excesivo suele ser bilateral, sin embargo, se han reportado casos unilaterales. Puede causar problemas clínicos como dolor en pecho, espalda y cuello, así como dilatación de las venas superficiales, cambios tróficos dermatológicos con ulceración de la piel y trastornos psicológicos (13 -16).
El mecanismo subyacente que causa la hipertrofia de la mama no ha sido dilucidado. Una teoría propuesta es una hipersensibilidad de los órganos diana a niveles normales de hormonas gonadales. Una hipótesis alternativa es que hay aumento de la actividad hormonal; sin embargo, estudios previos muestran niveles normales de estrógeno, progesterona, gonadotropinas y la hormona del crecimiento. La etiología del sobrecrecimiento mamario, no está clara, sin embargo se sabe que bajo la estimulación estrogénica, se produce el crecimiento de los ductos y de la grasa, mientras que la progesterona y la prolactina promueven el desarrollo de lóbulos y alveolos (17,9,18).
El diagnóstico es sencillo, pero se deben descartar diferenciales amplios como tumores fibroepiteliales (fibroadenoma y tumor filodes) y cambios fibroquísticos, que son más frecuentes que la hipertrofia mamaria virginal en este grupo de edad (19-21).
El ultrasonido mamario es el método ideal de imagen recomendado en la edad pediátrica, ya que identifica de forma adecuada tumoraciones en mamas con tejido fibroglandular abundante, el cual es característico en esta población (22). La Resonancia magnética nuclear se indica ante lesiones de sospecha.
Las modalidades de tratamiento en hipertrofia mamaria virginal incluyen cuatro estrategias: 1.- manejo quirúrgico, 2.- tratamiento médico preoperatorio 3.- tratamiento médico postoperatorio, y 4.- tratamiento médico solo (23).
La hipótesis hormonal ha sido la justificación de los intentos de controlar esta condición, utilizando medicamentos como tamoxifeno, danazol, bromocriptina, medroxiprogesterona y didrogesterona (10), pero la seguridad y eficacia de la farmacoterapia es desconocida actualmente.
Aunque hay reportes de casos tratados medicamente con estas drogas, como tamoxifeno (24), la mayoría de las adolescentes diagnosticadas con esta condición deben ser tratadas quirúrgicamente (24). El tratamiento antiestrogénico adyuvante postoperatorio es aceptado según Grolleau et al. Y ayuda a prevenir la recurrencia (25).
La modalidad terapéutica combinada, médica y quirúrgica, se lleva a cabo con la finalidad de detener el crecimiento de las mamas antes o después de la cirugía. El uso de moduladores médicos como el citrato de tamoxifeno y la medroxiprogesterona ha tenido resultados variables y los efectos secundarios no deben pasar por alto. El tamoxifeno es un antiestrógeno que causa regresión de tejido hipertrofiado, en contraste con didrogesterona y medroxiprogesterona, que solo ralentiza o detiene el crecimiento (25,3), por tanto es un complemento útil a la mamoplastia de reducción en la gigantomastia por hipertrofia mamaria juvenil. El conocido efecto secundario del tamoxifeno incluye el riesgo de cáncer de endometrio, tromboembolismo, calores súbitos (sofocos) y disminución de la densidad ósea (26).
La terapéuticas reportada en la literatura en los casos severos, es quirúrgica. Las opciones disponibles son: Mastectomía subcutánea (sin reposición de volumen, o con reposición del mismo con implantes) y la mamoplastia de reducción con sus modificaciones (técnica basada en pedículo o injerto de pezón). La mastectomía subcutánea con remoción casi total del tejido mamario, tiene menor probabilidad de recurrencia, pero produce más deformidad, por lo tanto, no es la opción de primera línea para muchos (25).
La mamoplastia reductora cuya tasa de recurrencia es mayor, e idealmente debe ser realizada cuando se estabiliza el tamaño de la mama (estadio 4 a 5 de Tanner) (25) podría ameritar tratamiento coadyuvante con anti estrógenos pre o post operatorio, aun así, es la opción terapéutica de preferencia. Siendo el procedimiento de elección para el tratamiento, basada en los resultados estéticos y las secuelas psicológicas de una mastectomía, es importante asesorar al paciente sobre la probabilidad de recurrencia después de la cirugía.
La mamoplastía de reducción con injerto autólogo de pezón es el enfoque preferido por encima de la técnica pediculada. Fiumara et al. enfatizaron la evidencia estadística de menor probabilidad de recurrencia hipertrófica con el uso de injerto de pezón que con la técnica basada en pedículo (p = 0,005) (27). Hisham et al. comunicaron un caso corregido quirúrgicamente con mamoplastía de reducción con injerto de pezón libre sin recurrencia a cinco años de seguimiento (10).
La razón por la cual se prefiere la mamoplastia reductora con injerto autólogo de areola-pezón es porque permite resecar suficiente tejido y así lograr los objetivos planteados con la cirugía, además de la seguridad para la vascularización del complejo areola-pezón. Por el contrario, la técnica basada en pedículo, que obliga a preservar una proporción no despreciable de tejido mamario para la vascularización del complejo areola- pezón, tiene una mayor probabilidad de recurrencia que pudiera requerir cirugía adicional. Además, el segmento largo de tejido mamario que utiliza como pedículo, puede comprometer el suministro de sangre durante la resección de gran volumen y conducir a un mayor riesgo de isquemia del complejo areola- pezón (19). Adicionalmente, tiene una mayor tasa de complicaciones.
De igual manera se debe señalar que el injerto de pezón tiene ciertas desventajas: pérdida de la lactancia, retorno variable de la sensibilidad y contractilidad del pezón, falla del injerto y, en ocasiones, cambios pigmentarios del complejo areola-pezón y aplanamiento de este último (19). Es necesario asesorar a la paciente y a sus familiares sobre las limitaciones de este procedimiento. No obstante, la mamoplastia de reducción es el procedimiento más recomendado a las adolescentes con esta patología y hacerlo una vez que se estabilice el tamaño de la mama. No obstante, en cierto casos no es posible esperar completar la maduración por el impacto desde el punto de vista físico y social que genera en la paciente.
Una forma rara de gigantomastia es la causada por hiperplasia estromal pseudoangiomatosa (PASH, por sus siglas en inglés) (28). PASH es una patología benigna de la mama debido a la proliferación de colágeno. A menudo diagnosticado incidentalmente en la biopsia de la mama, rara vez se manifiesta clínicamente y no se requiere seguimiento (29). Sin embargo, la PASH bilateral difusa, que es extremadamente rara, provoca un aumento rápido de la mama sin formar masas nodulares. La gigantomastia por PASH es muy rara (4).
La hiperplasia estromal pseudoangiomatosa de la mama, fue descrita por primera vez en 1986 por Vuitch et al (30). Es una proliferación benigna poco frecuente de células estromales mesenquimales, con formaciones de ranuras irregulares parecidas a estructuras angiomatosas. En la mayoría de los casos es un hallazgo microscópico focal en biopsias de mama realizadas por enfermedades benignas o malignas. Se puede presentar en forma difusa o nodular y en ocasiones como una masa palpable indolora, casi exclusivamente en mujeres premenopáusicas. Tiende a crecer con el tiempo y la mayoría de los casos se pueden curar mediante la extirpación y el pronóstico es bueno (31,32). La etiología exacta y la patogénesis de esta lesión sigue siendo desconocida, aunque ha sido postulada una respuesta proliferativa de mio- fibroblastos a estímulos hormonales. Histológicamente, se encuentran hendiduras ramificadas, bordeadas de miofibroblastos que se pueden anastomosar y confundirse con espacios vasculares, lo que lleva a un diagnóstico erróneo de angiosarcoma (33,34).
Adolescente femenina de 11 años y 7 meses de edad, con hipercrecimiento mamario bilateral que se inicia a los 10,5 años que progreso rápidamente en un período de 6 meses, produciendo dolor y alteración del equilibrio que dificultaba la deambulación y generó ausentismo escolar durante 1 año. Como antecedentes de importancia la madre se practicó mamoplastia reductora a los 14 años de edad (resección de 3,5 kg de tejido mamario). La telarquia de nuestra paciente fue a los 10 años y 6 meses y menarquia a los 11 años y 3 meses, ciclos regulares.
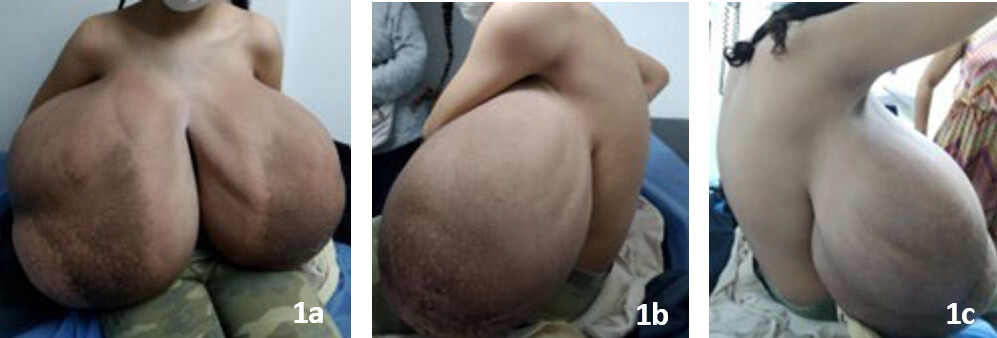
Al examen físico presentó una talla de 155 cm y peso de 62 Kg, IMC: 25,8 kg/m2 (percentil 96) estadio puberal de Tanner 5. Alteración postural caracterizada por cifosis dorsal. Marcha inestable por alteración del eje corporal. Tórax hipoexpansible, de tipo restrictivo. Marcados surcos a nivel de los hombros (asociado a presión ejercida por los tirantes del sostén). Mamas de gran volumen, dolorosas, con resequedad de la piel, presencia de fisuras, induración y eccema bilateral, estrías en toda la circunferencia de ambas mamas. Intertrigo en surcos submamarios. Sin adenopatías axilares (Figuras 1a, 1b, 1c).
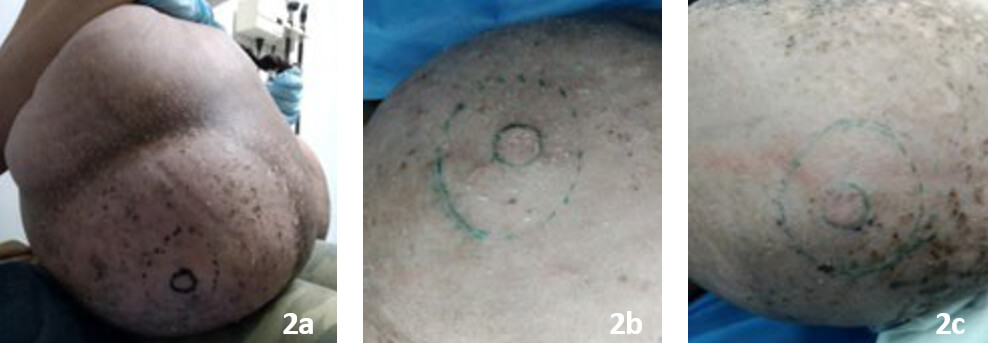
El complejo areola-pezón bilateral es poco visible, por lo cual fue necesaria la exploración minuciosa de la sensibilidad para su localización. La implantación es baja y la configuración alterada a expensas del diámetro aumentado, muy escasa pigmentación, con zonas costrosas, descamativas y aplanamiento de pezones, sin secreción (Figuras 2a, 2b, 2c). Estudio hormonal (función tiroidea, estrógenos, progesterona y prolactina) normal. Se realizó espirometría que reportó perturbación de la ventilación tipo mixto: restrictivo leve y obstructivo leve a predominio de medianas y grandes vías aéreas.
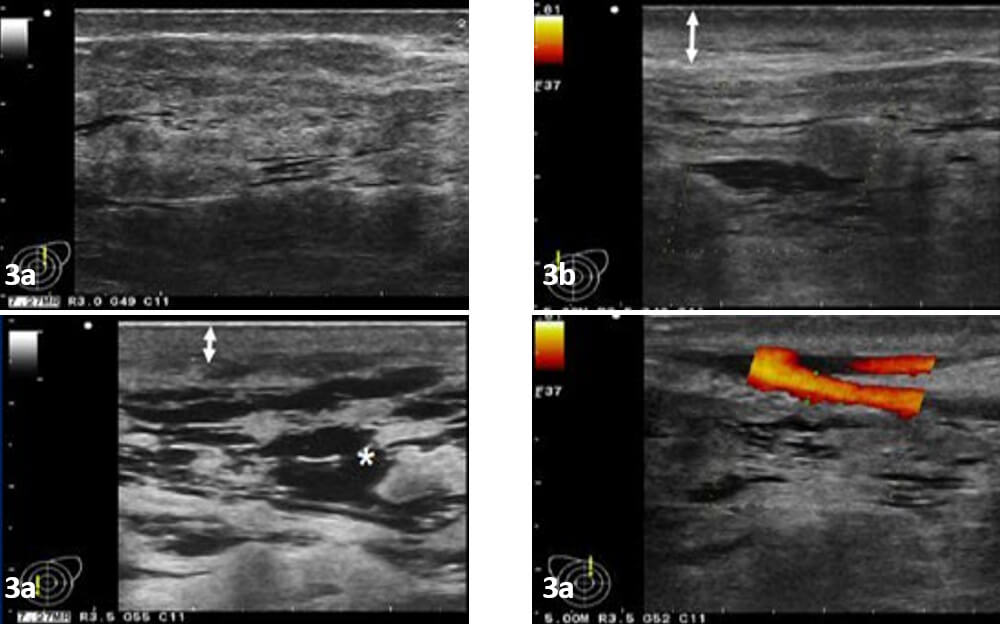
Se realizó ultrasonido mamario con transductor lineal de alta frecuencia en equipo ALOKA64. Se aprecian mamas voluminosas con abundante tejido fibroglandular (Figura 3a), engrosamiento de la piel (Figura 3b), congestión (Figura 3c) y vasculatura mamaria prominente en imagen Doppler.
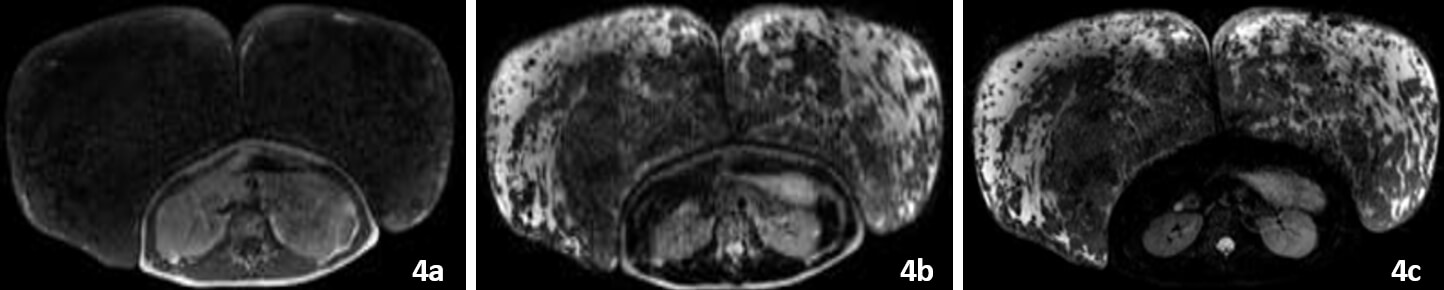
En la resonancia magnética, se evidencian en T1 mamas predominantemente hipointensas en relación con escaso tejido graso (Figura 4a). En T2 la hiperintensidad del tejido mamario bilateral sugiere congestión (Figura 4b, 4c).
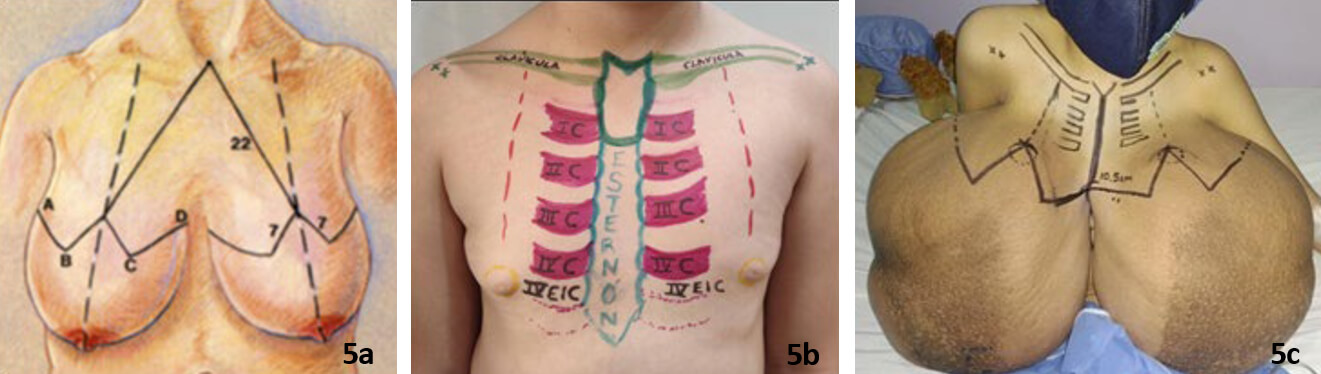
Se realizó un marcaje de mamoplastia reductora, según patrón de Wise (Figura 5a). Por tratarse de una paciente en período de crecimiento, se utilizaron como puntos de referencia, los correspondientes a su estructura ósea (Figura 5b). En este sentido, el complejo areola-pezón debe localizarse a nivel de la cuarta costilla en cada hemitórax: el punto de máxima proyección del pezón (Punto P) se ubicó en relación al borde inferior de la cuarta costilla y el cuarto espacio intercostal: Punto antropométrico de la cuarta costilla con el punto antropomórfico del pezón, y punto medio del hemitórax, entre línea axilar anterior y línea medio esternal, como referencias más objetivas para obtener resultados anatómicos y estéticos35. El marcaje sobre la paciente se realizó considerando las referencias anteriores (Figura 5c).
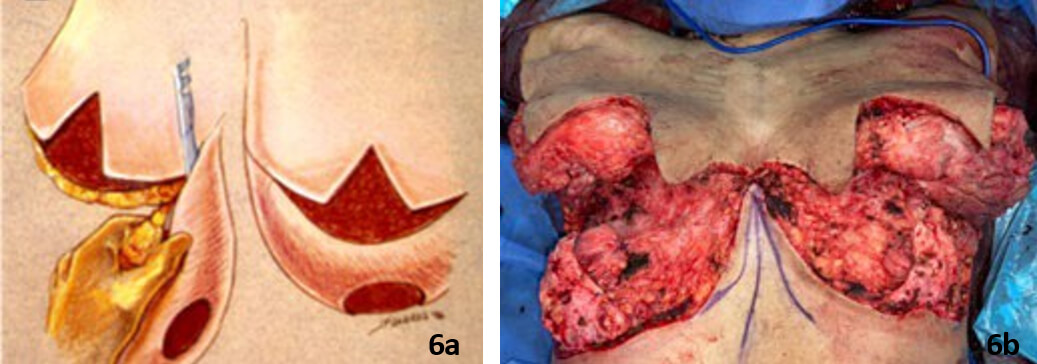
Se llevó a cabo el procedimiento quirúrgico inicialmente con el equipo de cirugía oncológica quien realizó reducción mamaria bilateral con remoción del 90 % del tejido mamario (Figura 6a, 6b).
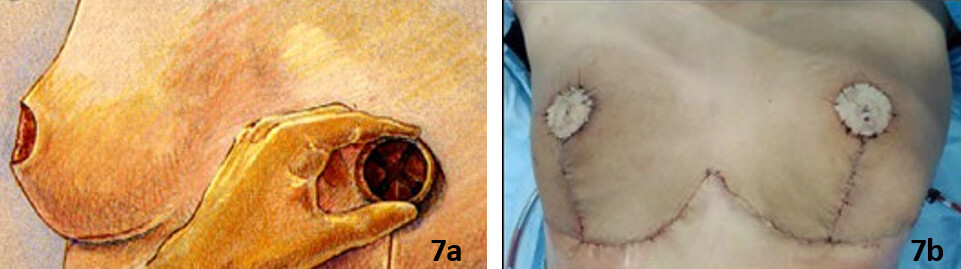
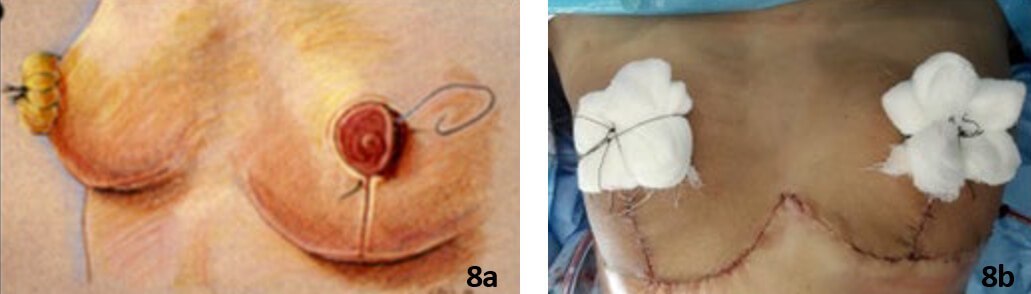
De forma inmediata se realizó la reconstrucción por cirugía plástica con técnica de mamoplastia reductora con injerto autólogo de complejo areola-pezón bilateral (Fig 7a, 7b. 8a,8b).
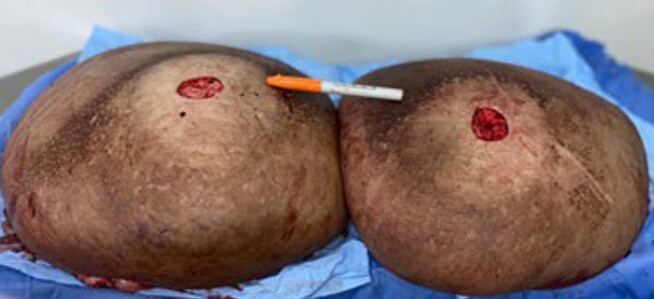
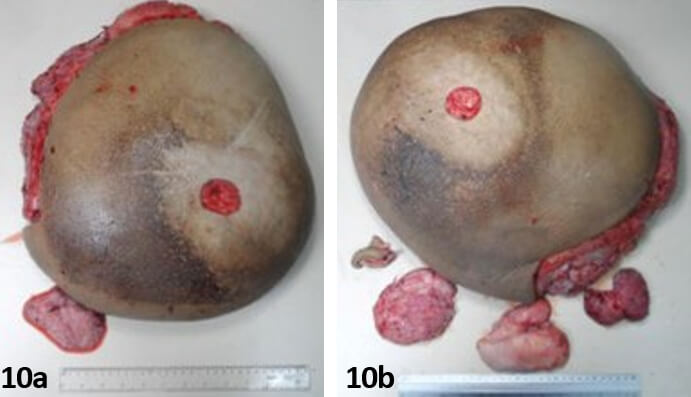
El peso del tejido resecado fue de 22,6 kg como sumatoria de ambas mamas (Figura 9). El hallazgo de anatomía patológica en su descripción macroscópica señala: mama derecha con un peso de 12.400 gr con medidas 46x45x12cm y mama izquierda con peso de 10.200 gr y con medidas 43x37x11 cm (Figura 10).
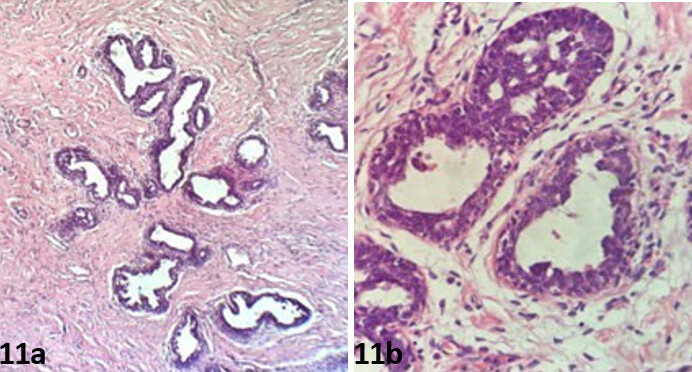
Los hallazgos histológicos fueron compatibles con hiperplasia mamaria virginal, en las láminas se observaban ductos y lobulillos pocos desarrollados, algunos muestran hiperplasia ductal sin atipias con dilataciones y cambios columnares inmersos en su estroma denso colagenoso, áreas focales pseudoangiomatosa (Figura 11a, Figura 11b).
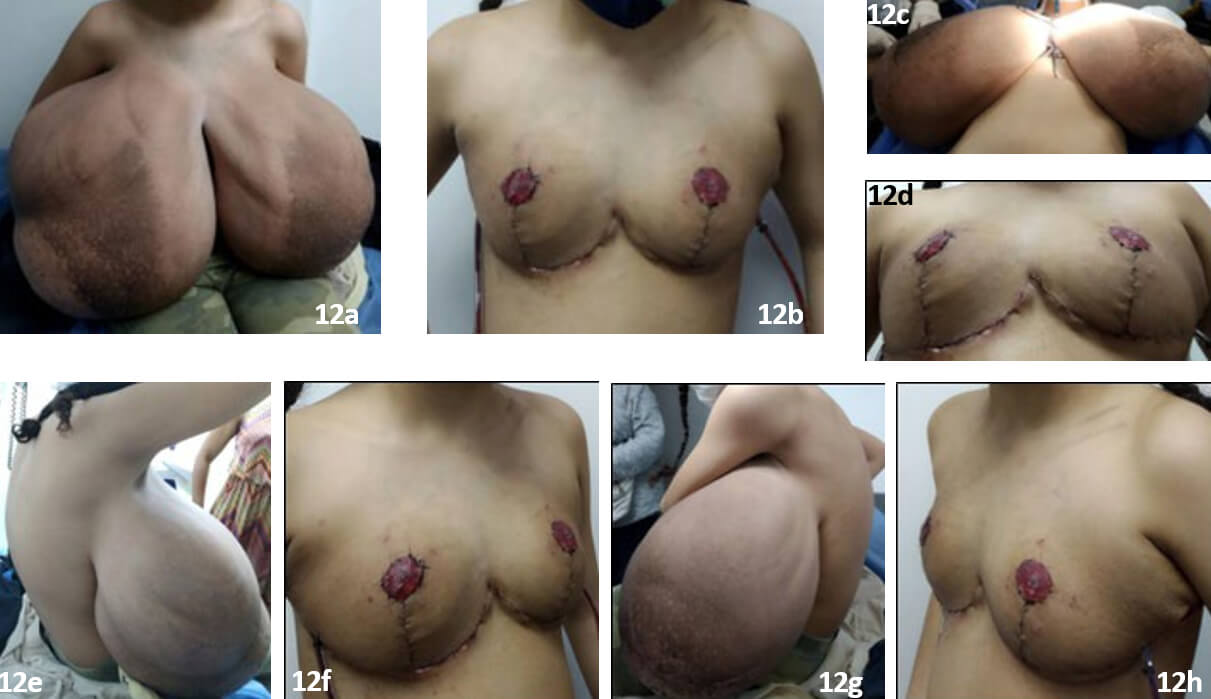
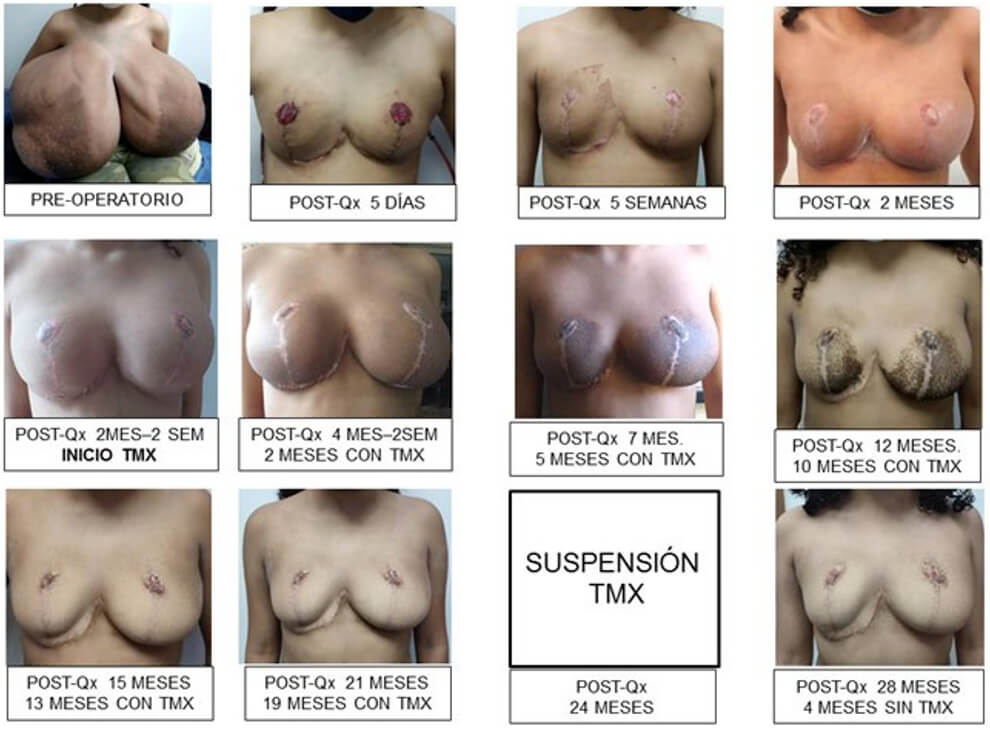
La evolución postoperatoria inmediata/mediata fue satisfactoria, Talla: 155 cm, peso: 44.9 kg, (25.6 % reducción del peso corporal) IMC 18,33 kg/m2 (percentil 50) mamas de configuración normal y cónsonas al desarrollo pondoestatural de la paciente, colgajos bien vascularizados, injertos de areola-pezón totalmente integrados. En fotografías antes y después de la cirugía, se aprecian los cambios experimentados en la paciente en proyección frontal (Fig 12a, 12b), caudo-craneal (Fig. 12c, 12d), oblicua-lateral derecha (Fig 12e, 12f) y oblicua- lateral izquierda (Fig. 12g, 12h).
Al momento de su presentación, la paciente tenía un IMC de 25,8 kg/m2, percentil 96, en el rango de obesidad, sin embargo al resecar 22,6 kg de tejido mamario, equivalente al al 35.6% de su peso corporal, su IMC se normaliza, 18,33 kg/m2, percentil 50 para su edad y sexo. Durante su recuperación postoperatoria (4 semanas), fue referida a consulta de fisioterapia, quien posterior a evaluación clínica, precisa debilidad generalizada en los cuatro miembros y tronco e hipertrofia gemelar. Es entonces referida a rehabilitación.
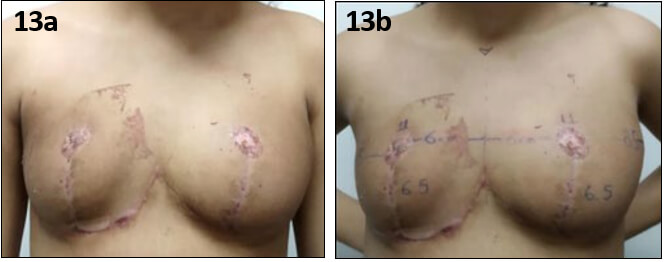
En reevaluación postoperatoria (6 semanas) se evidencia recrecimiento de tejido mamario, a predominio de mama izquierda, por lo cual es referida a endocrinología pediátrica, confirmado por ultrasonido (Fig. 13a, 13b).
Se inició terapia médica con Tamoxifeno a una dosis de 20 mg/día por 6 meses que se redujo a 10 mg/ día para completar 12 meses de tratamiento, con la resultante regresión del volumen mamario bilateral. La paciente pierde seguimiento, continúa el mismo tratamiento por 12 meses adicionales hasta cumplir 24 meses de tratamiento médico con tamoxifeno. Refiere ciclos menstruales regulares, satisfacción con el volumen de sus mamas, restablecimiento de sus actividades sociales y académicas (Fig 14).
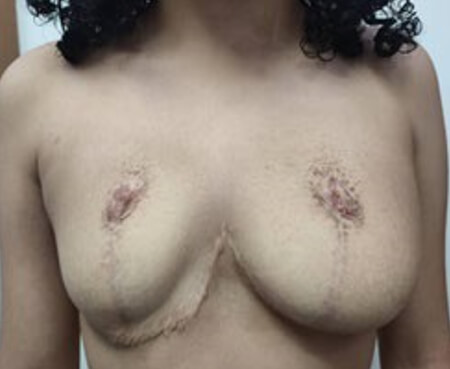
Refiere muy leve aumento del volumen mamario en los dos meses siguientes a la suspensión del tamoxifeno, que durante el tercer mes, se estabilizó. Actualmente, a cuatro meses posterior a la suspensión, el volumen mamario se mantiene estable. Se mantiene en seguimiento a largo plazo, lo cual es necesario para controlar las recurrencias después de la cirugía y de la suspensión del tratamiento antiestrogénico. Se muestra la secuencia fotográfica de la paciente (Fig 15).
La hiperplasia mamaria virginal es una condición poco frecuente que ocurre durante la pubertad, y debido a que su presentación clínica agresiva coloca a prueba la resistencia física y psíquica de las pacientes, la mayoría de los casos publicados son corregidos antes de los 15 años (4).
Aunque no existe un consenso, la hipertrofia mamaria virginal se describe como un aumento patológico superior a 1500 cm3 en el volumen de ambas mamas en adolescentes (25). Daffyd et al, define la gigantomastia como un exceso de tejido mamario que contribuye en un 3 % o más al peso corporal total de la paciente, aproximadamente una desviación estándar por debajo de la media (2). Considerando las medidas antropométricas en el caso descrito, más del 35 % de su peso correspondía al tejido mamario que posteriormente fue resecado, por lo cual se trata de una hipertrofia mamaria virginal que puede clasificarse como gigantomastia.
En la revisión de la literatura hecha por Dancey y Hoppe que presentan más de 150 casos, solo hay 2 donde el peso de la mama resecada se asemeja a la presentada en esta paciente (Albert, JAMA 1910; Harris, Aris Med 1945) (3,9).
En la mayoría de los casos el diagnóstico clínico es claro, a pesar de esto siempre debemos considerar otras patologías mamarias propias de la edad. El diagnóstico diferencial incluye fibroadenomas gigantes, tumores phyllodes y tumores malignos (linfomas o sarcomas), la prevalencia de estas lesiones en adolescentes con patología mamaria representa el 1%, 0,4% y 0,9% respectivamente (3).
La ecografía se considera el estudio de imágenes de primera línea debido a la densidad mamaria. Ante la sospecha de lesiones asociadas, se sugiere la resonancia magnética de mama (25). Tal y como fue dirigido el estudio de imágenes en este caso, el ultrasonido y la resonancia magnética de la mama permitieron la aproximación diagnóstica a esta patología y la exclusión de otras patologías ocultas, considerando su utilidad por la edad de la paciente y la densidad del tejido mamario.
No existe un manejo terapéutico estándar. Las modalidades incluyen tratamiento médico, quirúrgico o la combinación de ambos. La cirugía es el tratamiento de elección (24). Y la reducción mamaria es ahora un procedimiento quirúrgico común para la gigantomastia juvenil. En este caso, la paciente tenía mamas excesivamente voluminosas, que impedían la deambulación y la inhibían de cualquier contacto social, por lo que la reducción mamaria era absolutamente necesaria para aliviar los síntomas físicos y psicológicos.
Es una cirugía que se realiza con mayor frecuencia a partir de los 15-16 años con la finalidad de permitir finalizar la maduración de las mamas (25). sin embargo, en este caso, la franca afectación de sus actividades diarias, que impedía incluso la deambulación, fue el criterio para decidir instaurar tratamiento sin más retraso. Se realizó en un estadio 4-5 de Tanner, 4 meses post menarquia, cuando aún se podría esperar crecimiento y maduración de la glándula mamaria, lo que puede considerarse mayor riesgo de recurrencia. Adicionalmente, la mamoplastia reductora, estética y psicológicamente más aceptable que la mastectomía, deja tejido residual que aumenta la posibilidad de recrecimiento. Todo ello minuciosamente explicado a la paciente y sus padres.
El tratamiento antiestrogénico adyuvante postoperatorio es aceptado según Grolleau et al. y ayuda a prevenir la recurrencia (25). Estas drogas han demostrado ser efectivas para evitar el recrecimiento del tejido cuando se realiza mamoplastia reductora con tejido mamario remanente, aun sensible a la acción de los estrógenos con excelente respuesta, evitando la reintervención quirúrgica (9). En el caso de la adolescente, presentó recrecimiento mamario bilateral transcurridas seis semanas de postoperatorio, por lo cual fue necesario iniciar tratamiento con tamoxifeno. La respuesta fue favorable, presentando regresión del tejido glandular y sin reportar efectos secundarios al tratamiento. Actualmente, a cuatro meses de la suspensión del tamoxifeno, la paciente refiere muy ligero aumento del volumen mamario los dos primeros meses después de la suspensión, que se ha estabilizado actualmente.
El uso de Tamoxifeno como modulador selectivo del receptor estrogénico en el tejido mamario compite antagónicamente con los estrógenos a nivel de su receptor causando un efecto antiestrogénico. En los casos de hipertrofia mamaria benigna, el efecto de regresión del tejido hipertrofiado propio del tamoxifeno3 lo hace útil como complemento a la mamoplastia de reducción en la gigantomastia juvenil, por ello es el medicamento más utilizado actualmente (25).
Siendo el tratamiento quirúrgico la piedra angular en estos casos de gigantomastia, la técnica seleccionada fue la de abordaje con patrón de Wise, que es la más utilizada. Puede ser pediculada o se puede realizar una amputación con injerto autólogo del complejo areola-pezón, según fue descrito inicialmente por Thorek. Esta técnica consiste en la extirpación de la totalidad del polo inferior de la mama, sin preservación de pedículo (que irrigue el complejo areola-pezón) y el montículo mamario se reconstruye con piel superior medial y lateral. También es viable realizar alguna variante de esta técnica. En este caso, se modificó parcialmente la técnica, porque la resección no se limitó al polo inferior, sino que tomó parte del polo superior para lograr una resección de aproximadamente el 90% del tejido mamario.
En 1922, Thorek describió la mamoplastía estándar de reducción con injerto de pezón en la gigantomastia. La escasa proyección del complejo areola-pezón entre otros inconvenientes de esta técnica, han contribuido a su reemplazo por técnicas pediculadas (3). No obstante, el gran volumen mamario en el caso de esta adolescente, avala la técnica del injerto por su simplicidad y confiabilidad, Su uso se justifica por la gran cantidad de tejido mamario que sería necesario preservar en la técnica pediculada, para nutrir el complejo areola- pézón, que haría de esta reducción un procedimiento subóptimo en términos de la proporción de tejido a resecar. Así mismo, la gran distancia existente entre los pedículos mamarios y el complejo areola-pezón en esta adolescente, derivaría en un procedimiento inseguro para la vascularización del complejo areola- pezón.
En la planificación preoperatoria, se tomó como referencia la estructura ósea de la paciente, para ubicar correctamente sus neomamas acorde a sus proporciones corporales, considerando que no se debe utilizar las medidas estándares para mamoplastia reductora por tratarse de una adolescente en período de crecimiento, que aun no ve completado el desarrollo de sus mamas. Así mismo,tal y como lo señala Gil Bernardette et al las referencias basadas en medidas tradicionales han mostrado ser imprecisas, mientras que las estructuras fijas del esqueleto torácico que se relacionan con estructuras y referencias de la mama (pezón, surco submamario y meridiano mamario), brindan mayor objetividad en la planificación (35).
La hiperplasia estromal pseudoangiomatosa es una lesión proliferativa benigna del estroma mamario, con una prevalencia de 0,4 %. (9) Morita et al., describen que la enfermedad podía estar asociada a otras enfermedades como condición fibroquistica (14,1 %), fibroadenoma (0,9 %), y carcinoma (6,7 %) (36).
Comúnmente no tiene representación clínica como en la variedad difusa y se encuentra de forma accidental en biopsias aisladas de mama, o manifestarse como una lesión nodular palpable, única o múltiple, sin dolor, móvil, semiblanda, que puede ser bilateral y tan grande como 7 cm de diámetro.36 La hiperplasia estromal pseudoangiomatosa según algunas series puede observarse hasta el 23% de las biopsias de mama, en su contraparte se han reportado 10 casos asociados a gigantomastia idiopática del adulto (28,34). En el caso descrito la presentación fue la de un hallazgo patológico sin masa palpable de forma incidental en una paciente con hiperplasia mamaria virginal.
El diagnóstico diferencial más relevante es con el angiosarcoma de bajo grado, en el que se observan hematíes en los espacios vasculares y están completamente rodeada por células endoteliales atípicas y con actividad mitótica (37). Los hallazgos histológicos asociados de la hiperplasia estromal pseudoangiomatosa de la mama son los cambios fibroquísticos, hiperplasia ductal sin atipia, adenosis, metaplasia apocrina, cambios fibroadenomatosos, cambios similares a ginecomastia, pero pocas veces relacionado a hiperplasia mamaria severa (gigantomastia) en un mismo contexto clínico38,39. En el presente caso, la hiperplasia estromal pseudoangiomatosa se observó junto con áreas de hiperplasia ductal sin atipias.